Inhalte
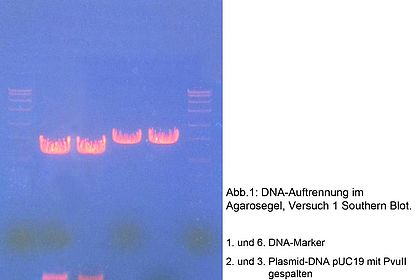
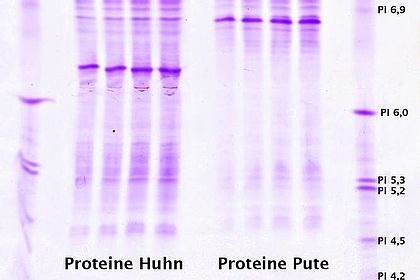
Die Chromatographie ist in der biotechnischen Aufarbeitung eine zentrale Methode, um Proteine z.B. aus Kulturbrühen zu isolieren und aufzureinigen. Die Studierenden lernen hier unterschiedliche chromatographische Techniken kennen und das Äkta-System bedienen. Versuche: Aufreingung der Lactoperoxidase aus Rohmilch und des rekombinanten GFP aus Escherischia coli
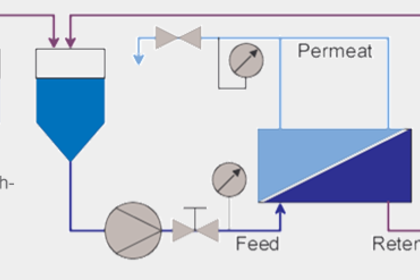
Die Ultrafiltration ermöglicht die Trennung von Lösungen mit hoch- und niedermolekularen Inhaltsstoffen. Sie ist bei der Gewinnung von Fermentationsprodukten Stand der Technik. Versuch: Aufkonzentrierung von Hefezellen und Entsalzung einer Hämoglobinlösung
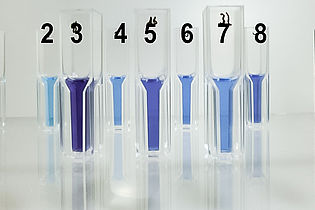
Bei der Flüssig-Flüssig Extraktion lernen die Studierenden eine weitere Methode kennen, um organische Wirkstoffe von einer Kulturbrühe abzutrennen. Versuch: Extraktion von BCG aus wässrigem Medium in das Lösungsmittel Ethylacetat und Rückextraktion
Zu den wichtigen Operationen bei der Aufarbeitung biotechnologischer Produkte gehört der Aufschluss von Gewebe und Zellen. Die Studierenden lernen die Vielfalt der Aufschluss- und Zerkleinerungstechniken in verschiedenen Versuchen kennen. Versuche: verschiedene Stationen mit Aufschluss- und Zerkleinerungsmaschinen.
Leitung:
Prof.Dr. Cristina Sirrenberg-Cruciat
Prof.Dr. Andreas Scheibe
Assistenten:
Dipl.-Ing.(FH) Bülent Turan
Laborraum: S04.107
Labortelefon: -3537